Лаборатория иммунохимии
- Дата публикации: 21.10.2018
Лаборатория иммунохимии (ЛИ) была организована в 1984 году, заведующий лабораторией д.х.н., профессор Сергей Юрьевич Щеголев. До 2003 года в ее состав входили группа иммунохимических и радиоизотопных методов анализа (рук. д.б.н., профессор Л.Ю. Матора), группа иммунотехнологии (рук. д.б.н. Л.А. Дыкман), группа физической химии биополимеров (рук. к.б.н. Н.В. Евсеева) и группа биофизики (рук. д.ф.-м.н., профессор, засл. деятель науки РФ Н.Г. Хлебцов). С апреля 2003 года группа биофизики была преобразована в самостоятельное структурное подразделение, ныне носящее название «Лаборатория нанобиотехнологии». В ноябре 2017 г. в результате объединения в состав ЛИ вошла лаборатория физиологии растительной клетки (ЛФРК) на правах группы с таким же названием (рук. д.б.н. О.И. Соколов). За время существования ЛИ и ЛФРК сотрудниками данных лабораторий защищены 19 кандидатских и 7 докторских диссертаций.
В настоящее время в ЛИ работают 14 сотрудников, в том числе 4 доктора и 6 кандидатов наук. Двое сотрудников имеют ученое звание профессора. Сотрудники лаборатории принимают активное участие в работе Учебно-научного центра физико-химической биологии Саратовского госуниверситета (СГУ) при ИБФРМ РАН, в учебном процессе Саратовского аграрного университета в качестве лекторов, руководителей курсовых и дипломных работ студентов, руководят работами аспирантов ИБФРМ РАН и СГУ, осуществляют научное консультирование работ соискателей научных степеней и докторантов.
Лаборатория осуществляет комплексные исследования межклеточных и межорганизменных коммуникаций в растительно-микробных ассоциациях и модельных системах животных клеток с применением биохимических, биоинформатических и развиваемых оригинальных иммунохимических методов. Их главной целью является получение новых сведений о молекулярных основах и механизмах функционирования исследуемых систем с оценками их значения для агробиотехнологии, медицины и ветеринарии.
Решение проблем межорганизменных коммуникаций с оценками перспектив направленного влияния на них во многих симбиозах, представляющих интерес для решения широкого круга фундаментальных и прикладных задач, непосредственно связано с изучением реакций бактериальных, растительных и животных клеток на контролируемые внешние воздействия. В том числе для идентификации и исследования новых синтетических и разнообразных природных биологически активных соединений.
Основные направления и задачи исследований:
• Изучение влияние сосуществования бактерий рода азоспирилл в целенаправленно создаваемых эктосимбиотических ассоциациях с хозяйственно-значимыми растениями в культуре in vitro на физиолого-биохимические и серологические характеристики реизолятов, их способность к колонизации и стимулированию роста растений.
• Оценка действия препаратов поверхностных белков и липополисахаридов бактерий рода Azospirillum на морфогенез растений in vitro и анализ влияния ростстимулирующих коллекционных штаммов бактерий, а также природных изолятов из ризосферы растений, на рост, развитие и резистентность микрорастений in vitro и последующую их приживаемость к нестерильным условиям почвы.
• Получение и сравнительный биоинформатический анализ таксономических и молекулярно-генетических характеристик ризосферных бактерий по результатам секвенирования их ДНК, в том числе представленным в общественно доступных базах данных, с применением современных молекулярно-филогенетических и структурно-аналитических методов.
• Исследование предполагаемого феномена сосуществования бактерий с растительными клетками (природного эндосимбиоза) в длительно поддерживаемых суспензионных культурах.
• Идентификация и изучение соединений природного и синтетического происхождения, обладающих разнообразными биологическими активностями, с использованием культур бактериальных, растительных и животных клеток.
• Оценка влияния наночастиц золота на эффективность иммунного ответа в связи с обнаруженными адъювантными свойствами коллоидного золота, апробация получаемых нановакцин против бактериальных, вирусных и паразитарных инфекций на лабораторных животных.
• Изучение влияния наночастиц благородных металлов на активность ферментных систем растений и микроорганизмов.
• Разработка методик получения мини-антител с использованием технологии фагового дисплея.
Наиболее значимые результаты
Описан принципиально новый характер микробной R-S диссоциации, обусловленный перераспределением вкладов двух разных (полноценных) О-специфических полисахаридов в архитектуру клеточной поверхности бактерий в зависимости от возраста культур.
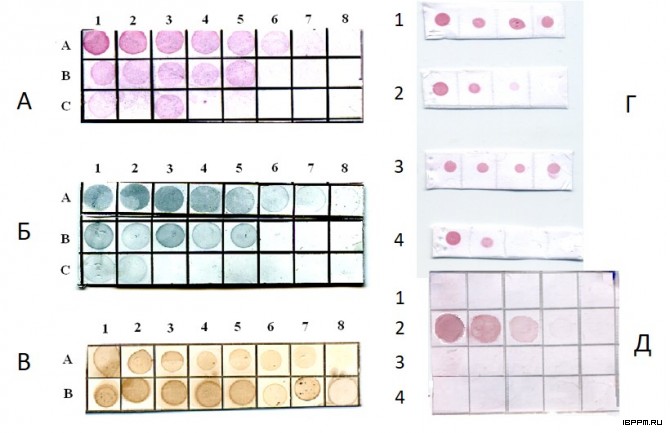
Создана биотест-система серологической идентификации почвенных ассоциативных азотфиксирующих бактерий рода Azospirillum, учитывающая иммунохимические особенности их углеводных и белковых антигенов. Лаборатория располагает набором антител (Ат) к поверхностным компонентам 27 штаммов 11 видов 7 родов ассоциативных бактерий – белковым и углеводным бактериальным структурам, выполняющим ключевую роль в растительно-микробных взаимодействиях. По результатам применения комплекса иммунохимических методов с учетом сходства и различий серологических свойств О-антигенов проведено серотипирование 74-х коллекционных штаммов 7 видов азоспирилл (в том числе, выделенных из почв Саратовской области), разделенных на 3 серогруппы и 37 серовариантов. Серологическая классификация азоспирилл имеет большое значение для экологических исследований, анализа распространенности бактерий в почве и прогнозирования активности бактериальных штаммов во взаимодействии в макропартнерами. Оценены корреляции серологических данных с результатами анализа химического строения О-специфического полисахарида, таксономическими характеристиками штаммов, что может стать важным этапом их системного анализа, отражающим связь установленных фено(серо)типов с эволюционной историей бактерий рода азоспирилл.
Получены сведения о химическом строении иммунодоминантных участков липополисахаридов (ЛПС) модельных штаммов Azospirillum brasilense. Установлены вклады O- и H-антигенов в архитектуру клеточной поверхности азоспирилл, оценено влияние плазмидного состава на ее антигенные свойства (совместно с лабораторией генетики микроорганизмов – ЛГМ ИБФРМ РАН).
В составе флагеллина полярного жгутика 22 штаммов азоспирилл выявлено наличие углеводных фрагментов, что существенно расширяет круг примеров данной посттрансляционной модификации флагеллина у Azospirillum. Совместно с сотрудниками лаборатории химии углеводов ИОХ РАН выделены и исследованы углеводные фрагменты гликозилированного флагеллина полярного жгутика типового штамма A. brasilense Sp7. Впервые для бактерий в составе флагеллина полярного жгутика установлено наличие О-связанного полисахарида с молекулярной массой 7,7 кДа, определено химическое строение его повторяющегося тетрасахаридного звена. Методом гомологичного моделирования с использованием аминокислотной последовательности белка впервые определена 3D структура протеиновой основы флагеллина азоспирилл.
У гликозилированного флагеллина штаммов A. brasilense Sp245 и Sp7 (относящихся к разным серогруппам согласно характеристикам О-антигена) обнаружены штаммовые различия выявленных родоспецифичных белковых детерминант. Впервые для ассоциативных бактерий обнаружено стимулирующее влияние изолированного флагеллина полярного жгутика A. brasilense Sp245 на пролиферативную активность проростков пшеницы.
Обнаружена иммунохимическая идентичность углеводных фрагментов гликозилированного флагеллина одному из О-специфических полисахаридов соматического антигена данного штамма. С учетом полученных результатов, свидетельствующих об идентичности антигенных детерминант в составе капсульных полисахаридов, экзополисахаридов и ЛПС азоспирилл, это позволяет предположить наличие некоего общего пути (либо нескольких перекрещивающихся путей) биосинтеза углеводных поверхностных структур у бактерий рода Azospirillum.
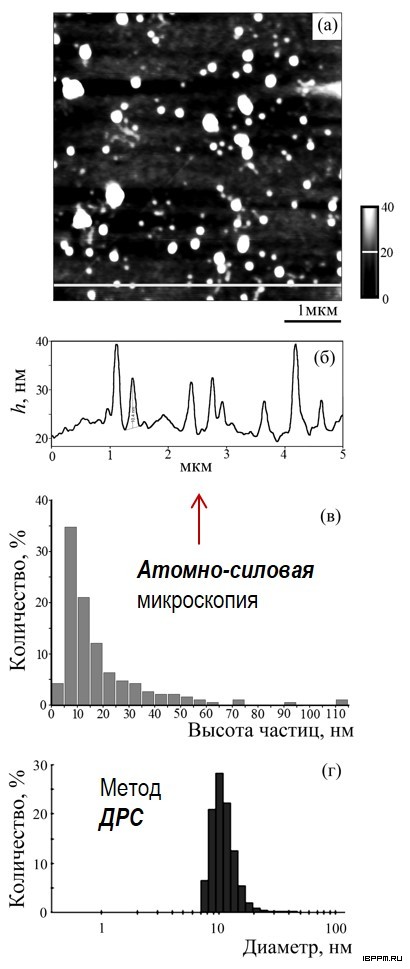
Методами динамического рассеяния света (ДРС) и атомно-силовой микроскопии охарактеризована надмолекулярная структура ЛПС 4-х штаммов азоспирилл, формирующаяся в водных средах и имеющая большое значение для межклеточных взаимодействий и реализации разнообразных проявлений биологической активности ЛПС. Обнаружено, что различия размера (диаметра в диапазоне 10-30 нм) и концентрации мицеллярных частиц ЛПС в установленных интервалах температуры с относительной стабильностью оптических характеристик взвесей зависят от особенностей химического строения молекул.
Для коллекционных штаммов бактерий рода Azospirillum, выделенных из разных экотопов, установлена близость их биохимических и физиологических свойств, а также сходство в строении поверхностных антигенов, что обеспечивает в итоге успешную колонизацию и стимулирование ими роста растений. Продемонстрирована серологическая взаимосвязь бактерий A. halopraeferens Au4 (представитель почвенного экотопа) и A. thiophilum BV-S (представитель водного экотопа) с представителями ранее описанных трёх серотипов азоспирилл. Для A. thiophilum BV-S показана способность колонизировать корни растений и рост-стимулирующая активность по отношению к проросткам пшеницы, коррелирующая с продукцией ауксина и азотфиксацией клетками данного штамма.
С использованием антител, специфичных к различным биомолекулам, экспонированным на наружной мембране A. brasilense, качественно и количественно охарактеризован вклад полисахаридных и белковых антигенов в реализацию разных типов коллективной подвижности азоспирилл (совместно с сотрудниками ЛГМ ИБФРМ РАН). Таких как образование бактериальных биопленок на границе раздела фаз, роение и коллективная миграция с образованием микроколоний. Полученные результаты свидетельствуют, в частности, о том, что заселение корневых волосков пшеницы азоспириллами происходит преимущественно по механизму распространения с образованием микроколоний.
Методом иммуноэлектронной микроскопии осуществлена визуализация поверхностных родоспецифичных белковых антигенов A. brasilense. На поверхности мутантного штамма A. brasilense SK048 (распространяющегося с образованием микроколоний и имеющего так называемый Gri+-фенотип) были выявлены структуры – предположительно пили, которые могут быть вовлечены в процесс его микроколониального распространения.
Методом молекулярного моделирования впервые для стимулирующих рост растений ризобактерий A. brasilense Sp245 определены 3D структуры семи белков, формирующих пилеподобные структуры, гены которых локализованы на плазмиде p4 данного штамма. В том числе препилина Flp IVb и шапероноподобного белка CpaB, влияющего на способность данного штамма к образованию биопленок.
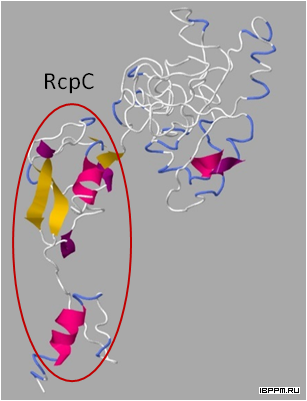
Впервые показано, что инокуляция ассоциативными бактериями рода Azospirillum микроклонов картофеля в культуре позволяет повысить эффективность технологии производства посадочного материала картофеля с улучшением приживаемости микрорастений в условиях открытого грунта и увеличением урожайности клубней. На этой основе отработан способ создания активного растительно-микробного симбиоза in vitro.
Показано, что присутствие ЛПС штамма A. brasilense Sp245 в среде культивирования стимулирует процессы вторичной дифференциации и регенерационную способность каллусных клеток пшеницы, повышая тем самым эффективность культивирования in vitro генотипов с низким эмбриогенным потенциалом. Полученные результаты свидетельствуют о принципиальной возможности его повышения с использованием ЛПС ассоциативных бактерий.
На примере бактериального изолята из ризосферы картофеля (Solanum tuberosum L.) сорта Невский, продемонстрирована неоднозначность его видовой идентификации по последовательностям гена 16S рРНК вследствие их высокой консервативности.
Идентичность последовательностей 16S рРНК в таксономической группе O. anthropi (http://old.ezbiocloud.net/eztaxon/taxonomic_group), включающей изолят IPA7.2 и представителей 10 различных видов, выделенных из контрастных экологических ниш: корней бобовых растений, ризосферы пшеницы, биологических жидкостей человека и др., существенно превосходит традиционный «золотой стандарт» разделения видов 97%. В состав 8 таких групп (треугольники) вошли от 2 до 28 разных видов, общим числом 64. Видовые отличия в них определяются иными физиолого-биохимическими и молекулярно-генетическими свойствами – с большой вероятностью горизонтальным переносом генов – и могут быть учтены с применением полифазного подхода при сочетании молекулярно-генетических данных с физиолого-биохимическими, хемотаксономическими, культуральными, экологическими и т.п. фенотипическими характеристиками изолятов. На этой основе данный изолят был идентифицирован как Ochrobactrum lupini IPA7.2, установлена его рост-стимулирующая активность по отношению к растениям картофеля и пшеницы в условиях in vitro и ex vitro.
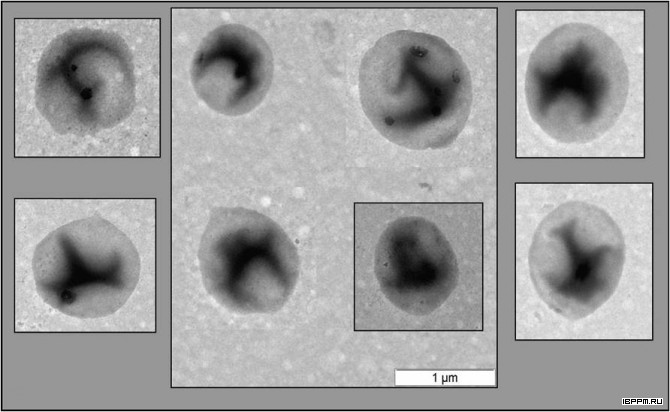
Было обнаружено, что в растительной суспензионной культуре Arabidopsis thaliana (L.) Heynh (ИФР РАН, 2006) присутствует не угнетающая ее рост бактериальная микрофлора – грамположительные, не обладающие кислотоустойчивостью бактерии с формой, близкой к сферической, диаметром около 1 мкм по результатам электронной микроскопии и динамического рассеяния света.
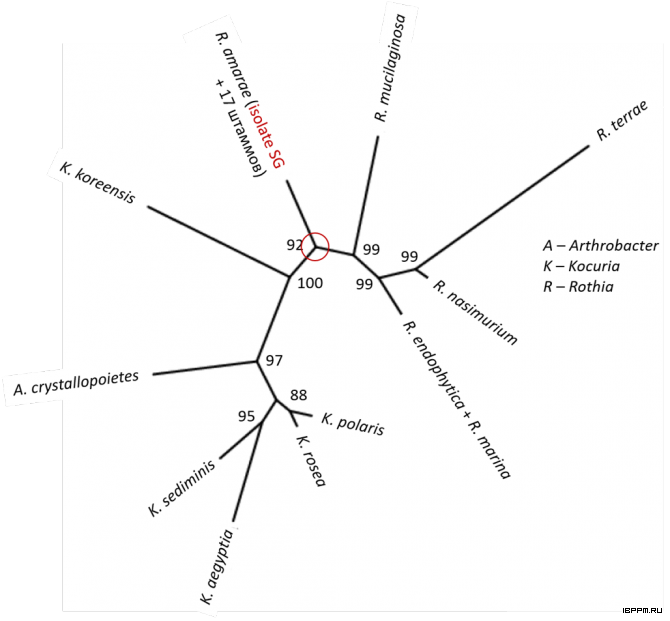
В таксономических исследованиях с использованием последовательностей гена 16S рРНК выделенный из суспензионной культуры арабидопсиса бактериальный штамм был отнесен к виду Rothia amarae.
Данный изолят оказался в составе таксономической группы с 18 штаммами этого вида с практически совпадающими последовательностями гена 16S рРНК (идентичность 99-100%). Однако среды обитания членов указанной группы варьируют в весьма широком спектре контрастных экологических ниш, включающих растения, почву, сточные воды, горные породы Антарктиды и др. Весьма вероятно, что адаптация к ним бактерий обусловлена специфическими наборами фенотипических и, соответственно, генотипических признаков, для выявление которых требуется привлечение результатов полногеномного секвенирования ДНК штаммов, не представленных по состоянию на сентябрь 2018 г. в базе данных NCBI для вида Rothia amarae.
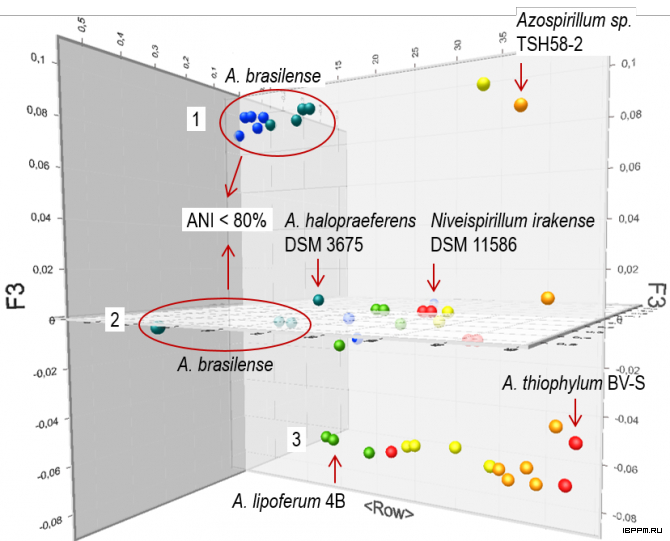
Нами проведены таксономические исследования исчерпывающего по состоянию на август 2018 г. набора результатов полногеномного секвенирования ДНК 46 бактериальных культивируемых (штаммов) и некультивируемых (метагеномных данных) объектов рода Azospirillum, представленного в базе данных NCBI. С использованием тестов средней нуклеотидной (ANI) и средней аминокислотной (AAI) идентичности, а также ДНК-ДНК гибридизации in silico (GGDC), методами NJ (ближайшего связывания) и PCoA (анализа главных координат) выявлена кластеризация геномов по трем монофилетическим группам. Две из них соответствуют межвидовому (внутриродовому) уровню ANI (80-95%) и AAI (60-90%), в то время как в третьей группе оказались 13 геномов с межродовыми значениями ANI < 80% и AAI < 60%.
По этим критериям бактериальные объекты (включающие метагеномные данные) с такими геномами (кластер 2 на рисунке) следует признать не соответствующими роду Azospirillum несмотря на то, что к данному роду их причислили (без особых объяснений) авторы геномов. Полученные результаты иллюстрируют актуальность существенных уточнений систематики прокариот с учетом таксономических соотношений, получаемых по итогам полногеномного секвенирования ДНК штаммов (метагеномных объектов) (Parks D.H. et al. A standardized bacterial taxonomy based on genome phylogeny substantially revises the tree of life. Nature Biotechnology, online 27 August 2018; doi: 10.1038/nbt.4229).
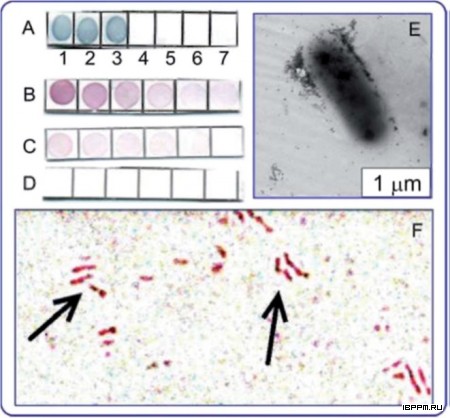
Впервые предложен вариант твердофазного ИФА микроосадков почвенных суспензий с использованием антител на ЛПС азоспирилл, позволяющий проводить выявление соматического бактериального антигена в почве. Исследована динамика выявления in situ соматического антигена интродуцированных в почву ассоциативных бактерий A. brasilense. Полученные результаты показали существенное влияние растений (пшеницы сорта Саратовская 29) на уровень развития бактерий данного рода в почве и зависимость численности экзогенной бактериальной популяции, оцениваемой по уровню обнаруженного ЛПС, от агротехнических воздействий на почву. Оценка распространенности азоспирилл в различных почвах, проведенная данным методом, впервые выявила значительное превышение вклада серотипа Sp245 по сравнению с серотипом Sp7 среди азоспирилл, представленных в микробоценозе почв Саратовской области. Данные по выживаемости азоспирилл, интродуцированных в почву и прикорневую зону растений, характеризуют их как жизнеспособный инокулянт, существование которого в почве в переживающей форме может длиться десятки суток.
Видное место в развитии методологии иммунохимических исследований в ЛИ занимает изучение уникальных физико-химических и биохимических свойств наночастиц золота и их биоконъюгатов. Данные работы были начаты с середины 1980-х годов в совместных исследованиях сотрудников ЛИ и лаборатории биофизических методов исследования (в то время) задолго до обнародования в 2001 году Нанотехнологической инициативы как национального проекта США и последующего признания нанотехнологий в качестве одного из приоритетных направлений развития российской науки. В настоящее время они ведутся в тесном взаимодействии с сотрудниками лаборатории нанобиотехнологии ИБФРМ РАН.
В этих исследованиях были оптимизированы методики получения конъюгатов разнообразных биоспецифических зондов с наночастицами коллоидного золота (КЗ) различных размеров и форм (наносферы, наностержни, нанооболочки, наноклетки, нанозвезды). Впервые в отечественной практике было обеспечено получение маркеров в широком спектре биоспецифических зондов и размеров частиц КЗ для электронной микроскопии, для твердофазного био- и иммуноанализа, иммунохроматографии и т.п. Были созданы условия для производства опытных партий золотосодержащих биоспецифических маркеров, используемых в исследованиях по биохимии, биотехнологии, медицине, ветеринарии и т.п. Полученные результаты иллюстрируют эффективность КЗ в качестве инструмента для анализа бактериальных и растительных клеточных структур, оценки относительной гидрофобности бактериальной поверхности, диагностики ряда инфекционных заболеваний животных и человека и др.
С применением КЗ в качестве носителя антигенов и адъюванта (in vivo) и метода фагового дисплея (in vitro) развиты процедуры получения антител к разнообразным антигенам и гаптенам. Получены приоритетные данные, позволяющие судить о возможных иммунологических механизмах впервые обнаруженного адъювантного действия наночастиц золота – одного из 12 самых удивительных свойств золотых гидрозолей по мнению специалистов, отраженному в одном из обзоров по соответствующей проблематике (Brown C.L. et al. Colloidal metallic gold is not bio-inert // Inflammopharmacology. 2008. Vol. 16. P. 133-137; doi: 10.1007/s10787-007-0017-6.). Методом фагового дисплея наработаны мини-антитела к целым животным и бактериальным клеткам, использованные для их выявления и исследования в иммунохимических тестах.
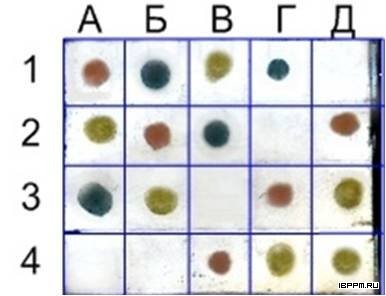
Установлено, что разработанная впервые процедура иммуноаффинной очистки кроличьих антимышиных антител позволяет выделить их фракцию, реагирующую исключительно с детерминантами IgG мыши. Сложность получения высокоспецифичных вторичных антител на иммуноглобулины мыши и крысы обусловлена тем, что исходные антитела этих грызунов имеют антигенные перекрёсты, вызванные наличием в их структуре общих антигенных детерминант. Эффективность полученных in vivo высокоселективных антител к иммуноглобулинам мыши и крысы продемонстрирована в мультиплексном дот-анализе с золотосеребряными наноклетками (nanocages). Подобранные параметры наноклеток обеспечили окраску в разные цвета мест связывания полученных высокоспецифичных антител с разными мишенями (куриными, крысиными и мышиными IgG).
Показано, что золотые наночастицы и их конъюгаты с низко- и высокомолекулярными антигенами стимулируют дыхательную активность клеток ретикулоэндотелиальной системы и активность митохондриальных ферментов макрофагов и (в ряде случаев) продукцию провоспалительных цитокинов. Это может быть одним из существенных факторов, определяющих обнаруженные нами адъювантные свойства КЗ. Последние создают, в частности, основу для его применения при производстве вакцин нового поколения.
В опытах с иммунизацией животных гриппозным антигеном, конъюгированным с коллоидным золотом, а также с наночастицами селена, впервые использованными в качестве носителей антигенов для получения антител in vivo против вирусов гриппа и трансмиссивного гастроэнтерита, выявлена выраженная стимуляция пролиферативной активности клеток селезенки и выработки интерферона, а также активация образования антител. В списке разнообразных антигенов, значимых для фундаментальных и прикладных исследований, против которых нами были получены in vivo антитела с использованием адъювантных свойств наноносителей, представлены: бактериальные антигены (Yersinia pseudotuberculosis, Yersinia enterocolitica, Salmonella typhimurium, Francisella tularensis, Mycobacterium tuberculosis, Vibrio cholerae), вирусные антигены (ящура, гриппа, трансмиссивного гастроэнтерита), антибиотики, биотин, -метиацил-коэнзим А рацемаза (AMACR), протеинкиназа и карбоангидраза цианобактерии Synechocystis и др. Полученные результаты позволяют рассматривать данные наночастицы как эффективное иммуномодулирующее средство, которое может быть использовано для создания на его основе нового поколения химических вакцин.
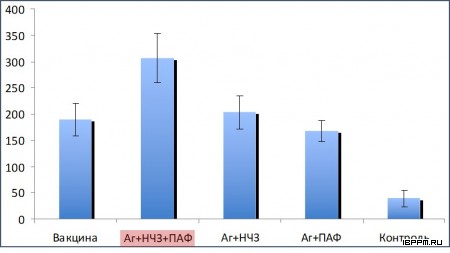
Проведена оценка влияния размеров и формы наночастиц золота (НЧЗ) и различных комбинаций НЧЗ и CpG-олигодезоксинуклеотидов на иммунный ответ. При иммунизации мышей модельным антигеном (БСА), конъюгированным с золотыми наносферами (диаметром 15 и 50 нм), наностержнями, нанооболочками и нанозвездами обнаружены существенные различия титров полученных антител. Титр антител снижался в ряду НЧЗ-50 > НЧЗ-15 > нанооболочки > нанозвезды > наностержни > нативный БСА. Таким образом, для применения НЧЗ в качестве носителя антигенов и адъюванта при иммунизации оптимально использование золотых наносфер диаметром 50 или 15 нм. Самый высокий титр антител к БСА был получен из сыворотки крови мышей, иммунизированных одновременно конъюгатами БСА/НЧЗ и CpG/НЧЗ.
Исследовано влияние наночастиц золота и серебра на рост суспензионной культуры клеток Arabidopsis thaliana. Показано, что добавление в среду культивирования наночастиц золота и серебра диаметром 20 нм стимулирует прирост биомассы суспензионной культуры клеток Arabidopsis thaliana (L.) Heynh. Установлен различный характер изменения рН среды при культивировании клеток с наночастицами серебра и золота: наночастицы серебра вызывали выраженное закисление культуральной среды, наночастицы золота – защелачивание. По результатам МТТ-теста металлические наночастицы оказывали относительно слабое, но устойчивое снижение удельной дыхательной активности клеток суспензионной культуры A. thaliana. При культивировании с наночастицами отмечено увеличение внутриклеточного пула свободных аминокислот – аланина, гамма-аминомасляной кислоты, валина – характерное для ответных реакций на абиогенные стрессы. Кроме того, добавление наночастиц вызывало изменение спектра экстраклеточных белков в культуре клеток A. thaliana.
Модификацией метода фракционирования и очистки бутирилхолинэстеразы человека из плазмы крови разработан метод иммобилизации высокоочищенной бутирилхолинэстеразы на поверхности наночастиц золота путем конъюгирования высокоочищенной бутирилхолинэстеразы с наночастицами золота диаметром 15 нм, полученными методом цитратного восстановления. Показано, что иммобилизация высокоочищенной бутирилхолинэстеразы человека на наночастицах золота приводила к значительному (на 23%) увеличению удельной активности фермента.
Комбинаторная фаговая библиотека, входящая в состав современных генно-инженерных технологий получения in vitro гипервариабельных участков иммуноглобулинов – мини-антител – использована для получения мини-Ат против мембранных структур опухолевых клеток, против ферритина с их применением для определения концентрации белка в сыворотке крови животных, против антигенов клеточной поверхности азоспирилл, а также для получения впервые мини-Ат к бактериофагам бактерий рода Azospirillum с оценками их специфичности. Данные мини-Ат могут быть использованы, в частности, для детектирования бактериофагов азоспирилл с применением акустоэлектронного и электрооптического анализа, разрабатываемых и применяемых в совместных исследованиях сотрудниками ИБФРМ РАН и СФ ИРЭ РАН. Заметим, что за разработку метода фагового дисплея пептидов и антител Д. Смиту и Г. Уинтеру была присуждена Нобелевская премия по химии 2018 года.
Перспективный современный подход на основе принципов «зеленой химии» применен для синтеза наночастиц золота и селена с использованием силимарина – флавоноида, получаемого из плодов и семян расторопши пятнистой. Полученные наноконъюгаты силимарина использованы для изучения их цитотоксичности по отношению к опухолевым и неопухолевым животным клеткам, показавшего ярко выраженный цитотоксический эффект в отношении линии опухолевых клеток Hep-2.
Научные интересы сотрудников группы ФРК связаны с изучением пространственно-временной организации и динамических изменений белков цитоскелета растений в зависимости от разнообразных внешних факторов. Динамичная структура актиновой составляющей цитоскелета является структурно-интегрирующей основой жизнедеятельности растительной клетки, обеспечивающей большой комплекс физиологических процессов: движение цитоплазмы, верхушечный рост пыльцевой трубки, корневых волосков, полярную ориентацию внутриклеточных органелл, участие в сигнальной системе и т.д.
Проводимые в этой области исследования включают: развитие методов визуализации микрофиламентов актина и тубулина, выделения и идентификации актинов из различных тканей растений; оценку роли актина в формировании микрорельефа поверхности протопластов клеток растений; анализ состояния цитоскелета клеток растений в зависимости от факторов внешней среды.
Кроме того, ведутся исследования механизмов образования, рецепции и физиологической роли олигосахаридных фрагментов в растительных тканях. Данные биомолекулы обладают плейотропным действием на клетки организмов различного уровня организации, участвуя в регуляции важнейших процессов жизнедеятельности. Это позволяет рассматривать олигосахариды как универсальные экстраклеточные сигнальные регуляторы межклеточных и межорганизменных взаимодействий.
Работы в данном направлении предусматривают изучение ферментативной фрагментации пектиновых полимеров растений, определяющих образование олигосахаридов различной степени полимеризации. Оценивается влияние структурно-функциональных модификаций пектиновых полисахаридов на их биологическую активность, действие пектиновых олигосахаридов на биосинтез и состав поверхностных и экстраклеточных протеомов клеток растений и микроорганизмов. Разрабатываются эффективные метки и зонды для выявления и исследования рецепторов олигосахаридов в растительных клетках.
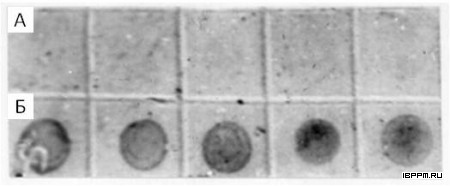
Долгое время считалось, что цитоскелет характерен лишь для эукариот. Однако с начала 1990-х годов стали публиковаться данные, свидетельствующие о наличии цитоскелета и у прокариот. В частности, методом дот-анализа с использованием конъюгата фаллоидина с коллоидным золотом в клетках штамма A. brasilense Sp245 нами был обнаружен актиноподобный белок.
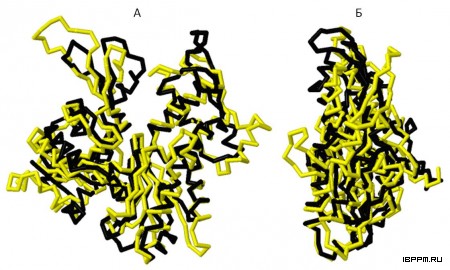
Это дало основания для анализа 3D структуры данного белка (MreB) и его сравнений со структурой растительного G-актина из Arabidopsis thaliana, проведенного нами впервые методом гомологичного моделирования по аминокислотной последовательности белка из генома A. brasilense Sp245, представленного в базе данных NCBI.
Можно отметить общее сходство 3D структур данных белков, при том что их аминокислотные последовательности идентичны только на 17,1%, а доля аминокислотных остатков со сходными физико-химическими и биохимическими характеристиками составляет 45,8%. Следует, однако, принимать во внимание, что механизмы и результаты функционирования актиноподобных белков MreB в клетках прокариот и их эволюционная история существенным образом отличаются от таковых для актинов эукариотических клеток (Doolittle R.F., York A.L. Bacterial actins? An evolutionary perspective. BioEssays. 2002. Vol. 24. P. 293-296; doi: 10.1002/bies.10079). К примеру, филаменты, образуемые белком MreB, служат для поддержания формы и контролируют размер палочкообразных клеток прокариот, но в геномах клеток сферической формы данный белок не обнаружен.
Разработан метод выделения и очистки гладкомышечного актина из животных тканей и получения на его основе антиактиновых антител. Получены конъюгаты золей коллоидного золота различного размера с очищенной фракцией IgG к актину. Разработан метод получения маркера на основе низкомолекулярного ингибитора полимеризации актина фаллоидина и коллоидного золота. Показана возможность дифференциальной оценки количества филаментной и глобулярной форм актинов с использованием этих маркеров с чувствительностью 15-50 нг белка.
Из предварительно обогащенных фракций цитозольных белков корней проростков пшеницы и эндокарпа плодов томата (защищенных от протеолиза) были выделены актиноподобные растительные белки разной степени очистки. Иммунохимический анализ показал различную эффективность выявления полипептидов в этих препаратах, что объясняется, по-видимому, более широкой вариабельностью структур актинов у растений по сравнению с животными.
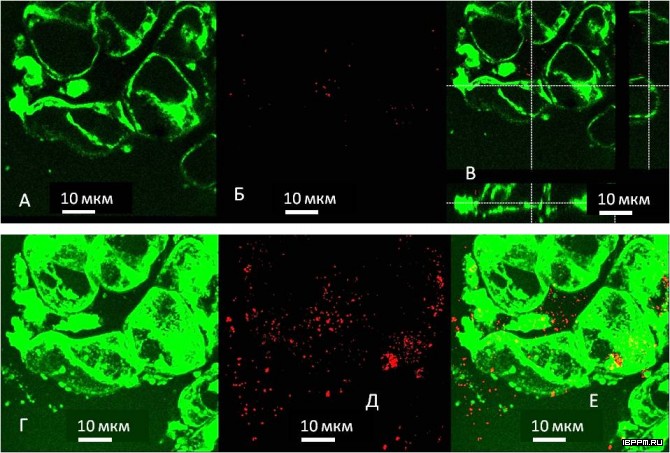
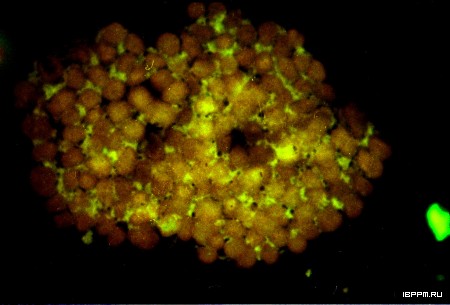
Идентификация актина методами электронной и флуоресцентной микроскопии с применением специфического маркера фаллоидин-коллоидное золото и флуоресцентного зонда фаллоидин-TRITC показала наличие в препаратах из различных тканей и органов растений как отдельных микрофиламентов, так и разветвленной сети пучков филаментов. Оценка распределения актина в субклеточных структурах препаратов тотальных, свободных и мембранносвязанных полисом из листьев конских бобов впервые показала связь полисом с филаментной формой актинового цитоскелета.
Методом сканирующей электронной микроскопии с модификацией, исключающей применение аппарата «критическая точка», получены данные об особенностях структуры поверхности и субкортикального слоя протопластов, позволяющие судить о топографии субкортикального цитоскелета, его связи с процессами синтеза клеточной стенки.
Показано, что в процессе ферментативного гидролиза пектиновых полимеров деградация молекулы деэтерифицированного пектина протекает дискретно и детерминированно, что проявляется в образовании стабильного спектра олигосахаридов. Химическая модификация пектинового полисахарида остатками глюкозамина сохраняет дискретность фрагментации молекулы полимера, но изменяет спектр образующихся олигосахаридных фрагментов. Установлена возможность направленного изменения активности и тканевой специфичности пектиновых олигосахаридов на основе модификации их структуры биоактивными лигандами.
Разработан оригинальный метод получения препаратов белков поверхности и клеточной стенки растительных клеток. Выявлена способность пектиновых поли- и олигосахаридов стимулировать процессы морфогенеза и изменять спектр белков поверхности у клеток суспензионной культуры A. thaliana, а также некоторых штаммов бактерий рода Azospirillum.
В течение всего срока существования группой ФРК проводится также научно-сервисная работа для подразделений института, а также для других научно-учебных организаций, с применением просвечивающей и сканирующей электронной, флуоресцентной и конфокальной микроскопии, проведением разделения и анализа белков и других метаболитов с помощью высокоэффективной жидкостной хроматографии, седиментационного фракционирования и анализа биополимеров.
Подводя итог приведенному выше краткому перечислению полученных нами данных можно констатировать, что значение результатов работ, посвященных развитию методологии иммунохимических, биохимических и микробиологических исследований, не ограничено только целями изучения растительно-микробных ассоциаций. Эти результаты могут быть применены (и фактически используются различными исследовательскими коллективами у нас в стране и за рубежом) в более широком круге биологических и биомедицинских исследований.
Работы сотрудников лаборатории поддержаны грантами Президента РФ для ведущих научных школ, РФФИ, РНФ, Миннауки РФ, Президиумом РАН в рамках программ «Фундаментальные науки – медицине» и «Фундаментальные основы технологий наноструктур и наноматериалов», международным грантом Седьмой рамочной программы Евросоюза и др.
Сотрудники ЛИ выступают в качестве рецензентов работ, представляемых к публикации в российских и зарубежных научных изданиях. Вед. науч. сотр. д.б.н. Л.А. Дыкман включен в список победителей престижных международных премий «Scopus Award Russia» за вклад в развитие науки на национальном и международном уровне 2015 г. и «Самые влиятельные исследователи по версии Thomson Reuters» 2015 г., является членом American Nano Society, выполнял работу эксперта по категории «Научно-техническая экспертиза и экспертиза образовательных проектов» корпорации «Роснано», был назначен экспертом по приоритетному направлению «Индустрия наносистем» Федерального реестра экспертов научно-технической сферы, наряду с сотрудниками лаборатории нанобиотехнологии ИБФРМ РАН отмечен в 2004 г. премией МАИК «Наука» за лучшую публикацию в издаваемых ею журналах. Старш. науч. сотр. д.б.н. С.А. Староверов являлся экспертом по приоритетному направлению «Биотехнология» Федерального реестра экспертов научно-технической сферы (2012-2015 гг.). Зав. лаб. С.Ю. Щеголев также зарегистрирован в Федеральном реестре экспертов научно-технической сферы (2013-2016 гг., 2017-2019 гг.).
За многолетний добросовестный труд на благо отечественной науки, практический вклад в обеспечение фундаментальных и прикладных научных исследований вед. науч. сотр. д.б.н. Л.Ю. Матора, вед. науч. сотр. д.б.н. Л.А. Дыкман и старш. науч. сотр. к.б.н. Н.В. Евсеева в 2010 г. награждены Почетной грамотой Президиума РАН и Центрального совета Профсоюза работников РАН. Науч. сотр. к.б.н. А.А. Широков в 2013 г. стал лауреатом молодежной премии им. П.А. Столыпина правительства Саратовской области за выдающиеся достижения в области науки. Зав. лаб. С.Ю. Щеголев в 2006 г. награжден медалью ордена «За заслуги перед Отечеством» II степени.
В настоящее время в ЛИ работают 14 сотрудников, в том числе 4 доктора и 6 кандидатов наук. Двое сотрудников имеют ученое звание профессора. Сотрудники лаборатории принимают активное участие в работе Учебно-научного центра физико-химической биологии Саратовского госуниверситета (СГУ) при ИБФРМ РАН, в учебном процессе Саратовского аграрного университета в качестве лекторов, руководителей курсовых и дипломных работ студентов, руководят работами аспирантов ИБФРМ РАН и СГУ, осуществляют научное консультирование работ соискателей научных степеней и докторантов.
Лаборатория осуществляет комплексные исследования межклеточных и межорганизменных коммуникаций в растительно-микробных ассоциациях и модельных системах животных клеток с применением биохимических, биоинформатических и развиваемых оригинальных иммунохимических методов. Их главной целью является получение новых сведений о молекулярных основах и механизмах функционирования исследуемых систем с оценками их значения для агробиотехнологии, медицины и ветеринарии.
Решение проблем межорганизменных коммуникаций с оценками перспектив направленного влияния на них во многих симбиозах, представляющих интерес для решения широкого круга фундаментальных и прикладных задач, непосредственно связано с изучением реакций бактериальных, растительных и животных клеток на контролируемые внешние воздействия. В том числе для идентификации и исследования новых синтетических и разнообразных природных биологически активных соединений.
Основные направления и задачи исследований:
• Изучение влияние сосуществования бактерий рода азоспирилл в целенаправленно создаваемых эктосимбиотических ассоциациях с хозяйственно-значимыми растениями в культуре in vitro на физиолого-биохимические и серологические характеристики реизолятов, их способность к колонизации и стимулированию роста растений.
• Оценка действия препаратов поверхностных белков и липополисахаридов бактерий рода Azospirillum на морфогенез растений in vitro и анализ влияния ростстимулирующих коллекционных штаммов бактерий, а также природных изолятов из ризосферы растений, на рост, развитие и резистентность микрорастений in vitro и последующую их приживаемость к нестерильным условиям почвы.
• Получение и сравнительный биоинформатический анализ таксономических и молекулярно-генетических характеристик ризосферных бактерий по результатам секвенирования их ДНК, в том числе представленным в общественно доступных базах данных, с применением современных молекулярно-филогенетических и структурно-аналитических методов.
• Исследование предполагаемого феномена сосуществования бактерий с растительными клетками (природного эндосимбиоза) в длительно поддерживаемых суспензионных культурах.
• Идентификация и изучение соединений природного и синтетического происхождения, обладающих разнообразными биологическими активностями, с использованием культур бактериальных, растительных и животных клеток.
• Оценка влияния наночастиц золота на эффективность иммунного ответа в связи с обнаруженными адъювантными свойствами коллоидного золота, апробация получаемых нановакцин против бактериальных, вирусных и паразитарных инфекций на лабораторных животных.
• Изучение влияния наночастиц благородных металлов на активность ферментных систем растений и микроорганизмов.
• Разработка методик получения мини-антител с использованием технологии фагового дисплея.
Наиболее значимые результаты
Описан принципиально новый характер микробной R-S диссоциации, обусловленный перераспределением вкладов двух разных (полноценных) О-специфических полисахаридов в архитектуру клеточной поверхности бактерий в зависимости от возраста культур.
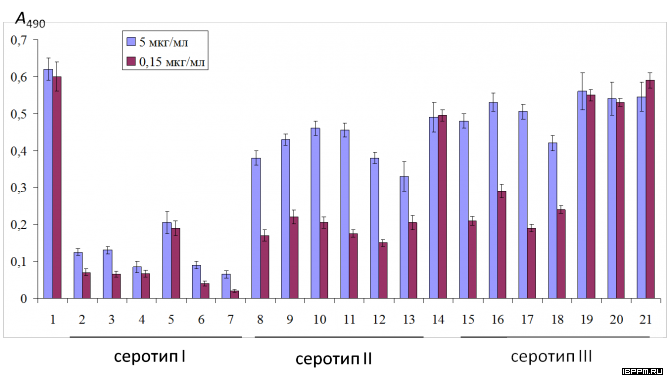
Создана биотест-система серологической идентификации почвенных ассоциативных азотфиксирующих бактерий рода Azospirillum, учитывающая иммунохимические особенности их углеводных и белковых антигенов. Лаборатория располагает набором антител (Ат) к поверхностным компонентам 27 штаммов 11 видов 7 родов ассоциативных бактерий – белковым и углеводным бактериальным структурам, выполняющим ключевую роль в растительно-микробных взаимодействиях. По результатам применения комплекса иммунохимических методов с учетом сходства и различий серологических свойств О-антигенов проведено серотипирование 74-х коллекционных штаммов 7 видов азоспирилл (в том числе, выделенных из почв Саратовской области), разделенных на 3 серогруппы и 37 серовариантов. Серологическая классификация азоспирилл имеет большое значение для экологических исследований, анализа распространенности бактерий в почве и прогнозирования активности бактериальных штаммов во взаимодействии в макропартнерами. Оценены корреляции серологических данных с результатами анализа химического строения О-специфического полисахарида, таксономическими характеристиками штаммов, что может стать важным этапом их системного анализа, отражающим связь установленных фено(серо)типов с эволюционной историей бактерий рода азоспирилл.
Получены сведения о химическом строении иммунодоминантных участков липополисахаридов (ЛПС) модельных штаммов Azospirillum brasilense. Установлены вклады O- и H-антигенов в архитектуру клеточной поверхности азоспирилл, оценено влияние плазмидного состава на ее антигенные свойства (совместно с лабораторией генетики микроорганизмов – ЛГМ ИБФРМ РАН).
В составе флагеллина полярного жгутика 22 штаммов азоспирилл выявлено наличие углеводных фрагментов, что существенно расширяет круг примеров данной посттрансляционной модификации флагеллина у Azospirillum. Совместно с сотрудниками лаборатории химии углеводов ИОХ РАН выделены и исследованы углеводные фрагменты гликозилированного флагеллина полярного жгутика типового штамма A. brasilense Sp7. Впервые для бактерий в составе флагеллина полярного жгутика установлено наличие О-связанного полисахарида с молекулярной массой 7,7 кДа, определено химическое строение его повторяющегося тетрасахаридного звена. Методом гомологичного моделирования с использованием аминокислотной последовательности белка впервые определена 3D структура протеиновой основы флагеллина азоспирилл.
У гликозилированного флагеллина штаммов A. brasilense Sp245 и Sp7 (относящихся к разным серогруппам согласно характеристикам О-антигена) обнаружены штаммовые различия выявленных родоспецифичных белковых детерминант. Впервые для ассоциативных бактерий обнаружено стимулирующее влияние изолированного флагеллина полярного жгутика A. brasilense Sp245 на пролиферативную активность проростков пшеницы.
Обнаружена иммунохимическая идентичность углеводных фрагментов гликозилированного флагеллина одному из О-специфических полисахаридов соматического антигена данного штамма. С учетом полученных результатов, свидетельствующих об идентичности антигенных детерминант в составе капсульных полисахаридов, экзополисахаридов и ЛПС азоспирилл, это позволяет предположить наличие некоего общего пути (либо нескольких перекрещивающихся путей) биосинтеза углеводных поверхностных структур у бактерий рода Azospirillum.
Методами динамического рассеяния света (ДРС) и атомно-силовой микроскопии охарактеризована надмолекулярная структура ЛПС 4-х штаммов азоспирилл, формирующаяся в водных средах и имеющая большое значение для межклеточных взаимодействий и реализации разнообразных проявлений биологической активности ЛПС. Обнаружено, что различия размера (диаметра в диапазоне 10-30 нм) и концентрации мицеллярных частиц ЛПС в установленных интервалах температуры с относительной стабильностью оптических характеристик взвесей зависят от особенностей химического строения молекул.

Для коллекционных штаммов бактерий рода Azospirillum, выделенных из разных экотопов, установлена близость их биохимических и физиологических свойств, а также сходство в строении поверхностных антигенов, что обеспечивает в итоге успешную колонизацию и стимулирование ими роста растений. Продемонстрирована серологическая взаимосвязь бактерий A. halopraeferens Au4 (представитель почвенного экотопа) и A. thiophilum BV-S (представитель водного экотопа) с представителями ранее описанных трёх серотипов азоспирилл. Для A. thiophilum BV-S показана способность колонизировать корни растений и рост-стимулирующая активность по отношению к проросткам пшеницы, коррелирующая с продукцией ауксина и азотфиксацией клетками данного штамма.
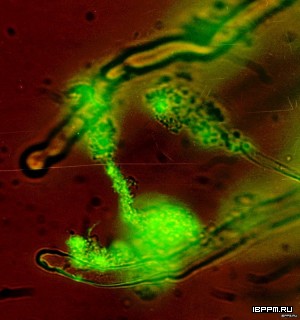
С использованием антител, специфичных к различным биомолекулам, экспонированным на наружной мембране A. brasilense, качественно и количественно охарактеризован вклад полисахаридных и белковых антигенов в реализацию разных типов коллективной подвижности азоспирилл (совместно с сотрудниками ЛГМ ИБФРМ РАН). Таких как образование бактериальных биопленок на границе раздела фаз, роение и коллективная миграция с образованием микроколоний. Полученные результаты свидетельствуют, в частности, о том, что заселение корневых волосков пшеницы азоспириллами происходит преимущественно по механизму распространения с образованием микроколоний.
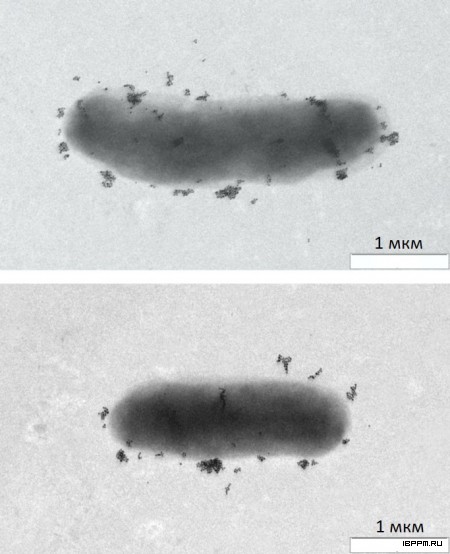
Методом иммуноэлектронной микроскопии осуществлена визуализация поверхностных родоспецифичных белковых антигенов A. brasilense. На поверхности мутантного штамма A. brasilense SK048 (распространяющегося с образованием микроколоний и имеющего так называемый Gri+-фенотип) были выявлены структуры – предположительно пили, которые могут быть вовлечены в процесс его микроколониального распространения.
Методом молекулярного моделирования впервые для стимулирующих рост растений ризобактерий A. brasilense Sp245 определены 3D структуры семи белков, формирующих пилеподобные структуры, гены которых локализованы на плазмиде p4 данного штамма. В том числе препилина Flp IVb и шапероноподобного белка CpaB, влияющего на способность данного штамма к образованию биопленок.

Впервые показано, что инокуляция ассоциативными бактериями рода Azospirillum микроклонов картофеля в культуре позволяет повысить эффективность технологии производства посадочного материала картофеля с улучшением приживаемости микрорастений в условиях открытого грунта и увеличением урожайности клубней. На этой основе отработан способ создания активного растительно-микробного симбиоза in vitro.
Показано, что присутствие ЛПС штамма A. brasilense Sp245 в среде культивирования стимулирует процессы вторичной дифференциации и регенерационную способность каллусных клеток пшеницы, повышая тем самым эффективность культивирования in vitro генотипов с низким эмбриогенным потенциалом. Полученные результаты свидетельствуют о принципиальной возможности его повышения с использованием ЛПС ассоциативных бактерий.
На примере бактериального изолята из ризосферы картофеля (Solanum tuberosum L.) сорта Невский, продемонстрирована неоднозначность его видовой идентификации по последовательностям гена 16S рРНК вследствие их высокой консервативности.
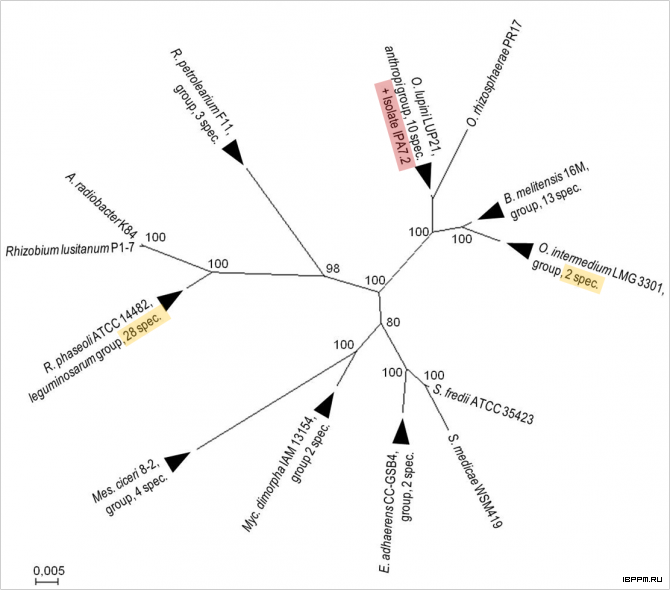
Идентичность последовательностей 16S рРНК в таксономической группе O. anthropi (http://old.ezbiocloud.net/eztaxon/taxonomic_group), включающей изолят IPA7.2 и представителей 10 различных видов, выделенных из контрастных экологических ниш: корней бобовых растений, ризосферы пшеницы, биологических жидкостей человека и др., существенно превосходит традиционный «золотой стандарт» разделения видов 97%. В состав 8 таких групп (треугольники) вошли от 2 до 28 разных видов, общим числом 64. Видовые отличия в них определяются иными физиолого-биохимическими и молекулярно-генетическими свойствами – с большой вероятностью горизонтальным переносом генов – и могут быть учтены с применением полифазного подхода при сочетании молекулярно-генетических данных с физиолого-биохимическими, хемотаксономическими, культуральными, экологическими и т.п. фенотипическими характеристиками изолятов. На этой основе данный изолят был идентифицирован как Ochrobactrum lupini IPA7.2, установлена его рост-стимулирующая активность по отношению к растениям картофеля и пшеницы в условиях in vitro и ex vitro.
Было обнаружено, что в растительной суспензионной культуре Arabidopsis thaliana (L.) Heynh (ИФР РАН, 2006) присутствует не угнетающая ее рост бактериальная микрофлора – грамположительные, не обладающие кислотоустойчивостью бактерии с формой, близкой к сферической, диаметром около 1 мкм по результатам электронной микроскопии и динамического рассеяния света.
В таксономических исследованиях с использованием последовательностей гена 16S рРНК выделенный из суспензионной культуры арабидопсиса бактериальный штамм был отнесен к виду Rothia amarae.
Данный изолят оказался в составе таксономической группы с 18 штаммами этого вида с практически совпадающими последовательностями гена 16S рРНК (идентичность 99-100%). Однако среды обитания членов указанной группы варьируют в весьма широком спектре контрастных экологических ниш, включающих растения, почву, сточные воды, горные породы Антарктиды и др. Весьма вероятно, что адаптация к ним бактерий обусловлена специфическими наборами фенотипических и, соответственно, генотипических признаков, для выявление которых требуется привлечение результатов полногеномного секвенирования ДНК штаммов, не представленных по состоянию на сентябрь 2018 г. в базе данных NCBI для вида Rothia amarae.
Нами проведены таксономические исследования исчерпывающего по состоянию на август 2018 г. набора результатов полногеномного секвенирования ДНК 46 бактериальных культивируемых (штаммов) и некультивируемых (метагеномных данных) объектов рода Azospirillum, представленного в базе данных NCBI. С использованием тестов средней нуклеотидной (ANI) и средней аминокислотной (AAI) идентичности, а также ДНК-ДНК гибридизации in silico (GGDC), методами NJ (ближайшего связывания) и PCoA (анализа главных координат) выявлена кластеризация геномов по трем монофилетическим группам. Две из них соответствуют межвидовому (внутриродовому) уровню ANI (80-95%) и AAI (60-90%), в то время как в третьей группе оказались 13 геномов с межродовыми значениями ANI < 80% и AAI < 60%.
По этим критериям бактериальные объекты (включающие метагеномные данные) с такими геномами (кластер 2 на рисунке) следует признать не соответствующими роду Azospirillum несмотря на то, что к данному роду их причислили (без особых объяснений) авторы геномов. Полученные результаты иллюстрируют актуальность существенных уточнений систематики прокариот с учетом таксономических соотношений, получаемых по итогам полногеномного секвенирования ДНК штаммов (метагеномных объектов) (Parks D.H. et al. A standardized bacterial taxonomy based on genome phylogeny substantially revises the tree of life. Nature Biotechnology, online 27 August 2018; doi: 10.1038/nbt.4229).
Впервые предложен вариант твердофазного ИФА микроосадков почвенных суспензий с использованием антител на ЛПС азоспирилл, позволяющий проводить выявление соматического бактериального антигена в почве. Исследована динамика выявления in situ соматического антигена интродуцированных в почву ассоциативных бактерий A. brasilense. Полученные результаты показали существенное влияние растений (пшеницы сорта Саратовская 29) на уровень развития бактерий данного рода в почве и зависимость численности экзогенной бактериальной популяции, оцениваемой по уровню обнаруженного ЛПС, от агротехнических воздействий на почву. Оценка распространенности азоспирилл в различных почвах, проведенная данным методом, впервые выявила значительное превышение вклада серотипа Sp245 по сравнению с серотипом Sp7 среди азоспирилл, представленных в микробоценозе почв Саратовской области. Данные по выживаемости азоспирилл, интродуцированных в почву и прикорневую зону растений, характеризуют их как жизнеспособный инокулянт, существование которого в почве в переживающей форме может длиться десятки суток.
Видное место в развитии методологии иммунохимических исследований в ЛИ занимает изучение уникальных физико-химических и биохимических свойств наночастиц золота и их биоконъюгатов. Данные работы были начаты с середины 1980-х годов в совместных исследованиях сотрудников ЛИ и лаборатории биофизических методов исследования (в то время) задолго до обнародования в 2001 году Нанотехнологической инициативы как национального проекта США и последующего признания нанотехнологий в качестве одного из приоритетных направлений развития российской науки. В настоящее время они ведутся в тесном взаимодействии с сотрудниками лаборатории нанобиотехнологии ИБФРМ РАН.
В этих исследованиях были оптимизированы методики получения конъюгатов разнообразных биоспецифических зондов с наночастицами коллоидного золота (КЗ) различных размеров и форм (наносферы, наностержни, нанооболочки, наноклетки, нанозвезды). Впервые в отечественной практике было обеспечено получение маркеров в широком спектре биоспецифических зондов и размеров частиц КЗ для электронной микроскопии, для твердофазного био- и иммуноанализа, иммунохроматографии и т.п. Были созданы условия для производства опытных партий золотосодержащих биоспецифических маркеров, используемых в исследованиях по биохимии, биотехнологии, медицине, ветеринарии и т.п. Полученные результаты иллюстрируют эффективность КЗ в качестве инструмента для анализа бактериальных и растительных клеточных структур, оценки относительной гидрофобности бактериальной поверхности, диагностики ряда инфекционных заболеваний животных и человека и др.
С применением КЗ в качестве носителя антигенов и адъюванта (in vivo) и метода фагового дисплея (in vitro) развиты процедуры получения антител к разнообразным антигенам и гаптенам. Получены приоритетные данные, позволяющие судить о возможных иммунологических механизмах впервые обнаруженного адъювантного действия наночастиц золота – одного из 12 самых удивительных свойств золотых гидрозолей по мнению специалистов, отраженному в одном из обзоров по соответствующей проблематике (Brown C.L. et al. Colloidal metallic gold is not bio-inert // Inflammopharmacology. 2008. Vol. 16. P. 133-137; doi: 10.1007/s10787-007-0017-6.). Методом фагового дисплея наработаны мини-антитела к целым животным и бактериальным клеткам, использованные для их выявления и исследования в иммунохимических тестах.

Установлено, что разработанная впервые процедура иммуноаффинной очистки кроличьих антимышиных антител позволяет выделить их фракцию, реагирующую исключительно с детерминантами IgG мыши. Сложность получения высокоспецифичных вторичных антител на иммуноглобулины мыши и крысы обусловлена тем, что исходные антитела этих грызунов имеют антигенные перекрёсты, вызванные наличием в их структуре общих антигенных детерминант. Эффективность полученных in vivo высокоселективных антител к иммуноглобулинам мыши и крысы продемонстрирована в мультиплексном дот-анализе с золотосеребряными наноклетками (nanocages). Подобранные параметры наноклеток обеспечили окраску в разные цвета мест связывания полученных высокоспецифичных антител с разными мишенями (куриными, крысиными и мышиными IgG).
Показано, что золотые наночастицы и их конъюгаты с низко- и высокомолекулярными антигенами стимулируют дыхательную активность клеток ретикулоэндотелиальной системы и активность митохондриальных ферментов макрофагов и (в ряде случаев) продукцию провоспалительных цитокинов. Это может быть одним из существенных факторов, определяющих обнаруженные нами адъювантные свойства КЗ. Последние создают, в частности, основу для его применения при производстве вакцин нового поколения.
В опытах с иммунизацией животных гриппозным антигеном, конъюгированным с коллоидным золотом, а также с наночастицами селена, впервые использованными в качестве носителей антигенов для получения антител in vivo против вирусов гриппа и трансмиссивного гастроэнтерита, выявлена выраженная стимуляция пролиферативной активности клеток селезенки и выработки интерферона, а также активация образования антител. В списке разнообразных антигенов, значимых для фундаментальных и прикладных исследований, против которых нами были получены in vivo антитела с использованием адъювантных свойств наноносителей, представлены: бактериальные антигены (Yersinia pseudotuberculosis, Yersinia enterocolitica, Salmonella typhimurium, Francisella tularensis, Mycobacterium tuberculosis, Vibrio cholerae), вирусные антигены (ящура, гриппа, трансмиссивного гастроэнтерита), антибиотики, биотин, -метиацил-коэнзим А рацемаза (AMACR), протеинкиназа и карбоангидраза цианобактерии Synechocystis и др. Полученные результаты позволяют рассматривать данные наночастицы как эффективное иммуномодулирующее средство, которое может быть использовано для создания на его основе нового поколения химических вакцин.
Проведена оценка влияния размеров и формы наночастиц золота (НЧЗ) и различных комбинаций НЧЗ и CpG-олигодезоксинуклеотидов на иммунный ответ. При иммунизации мышей модельным антигеном (БСА), конъюгированным с золотыми наносферами (диаметром 15 и 50 нм), наностержнями, нанооболочками и нанозвездами обнаружены существенные различия титров полученных антител. Титр антител снижался в ряду НЧЗ-50 > НЧЗ-15 > нанооболочки > нанозвезды > наностержни > нативный БСА. Таким образом, для применения НЧЗ в качестве носителя антигенов и адъюванта при иммунизации оптимально использование золотых наносфер диаметром 50 или 15 нм. Самый высокий титр антител к БСА был получен из сыворотки крови мышей, иммунизированных одновременно конъюгатами БСА/НЧЗ и CpG/НЧЗ.
Исследовано влияние наночастиц золота и серебра на рост суспензионной культуры клеток Arabidopsis thaliana. Показано, что добавление в среду культивирования наночастиц золота и серебра диаметром 20 нм стимулирует прирост биомассы суспензионной культуры клеток Arabidopsis thaliana (L.) Heynh. Установлен различный характер изменения рН среды при культивировании клеток с наночастицами серебра и золота: наночастицы серебра вызывали выраженное закисление культуральной среды, наночастицы золота – защелачивание. По результатам МТТ-теста металлические наночастицы оказывали относительно слабое, но устойчивое снижение удельной дыхательной активности клеток суспензионной культуры A. thaliana. При культивировании с наночастицами отмечено увеличение внутриклеточного пула свободных аминокислот – аланина, гамма-аминомасляной кислоты, валина – характерное для ответных реакций на абиогенные стрессы. Кроме того, добавление наночастиц вызывало изменение спектра экстраклеточных белков в культуре клеток A. thaliana.
Модификацией метода фракционирования и очистки бутирилхолинэстеразы человека из плазмы крови разработан метод иммобилизации высокоочищенной бутирилхолинэстеразы на поверхности наночастиц золота путем конъюгирования высокоочищенной бутирилхолинэстеразы с наночастицами золота диаметром 15 нм, полученными методом цитратного восстановления. Показано, что иммобилизация высокоочищенной бутирилхолинэстеразы человека на наночастицах золота приводила к значительному (на 23%) увеличению удельной активности фермента.
Комбинаторная фаговая библиотека, входящая в состав современных генно-инженерных технологий получения in vitro гипервариабельных участков иммуноглобулинов – мини-антител – использована для получения мини-Ат против мембранных структур опухолевых клеток, против ферритина с их применением для определения концентрации белка в сыворотке крови животных, против антигенов клеточной поверхности азоспирилл, а также для получения впервые мини-Ат к бактериофагам бактерий рода Azospirillum с оценками их специфичности. Данные мини-Ат могут быть использованы, в частности, для детектирования бактериофагов азоспирилл с применением акустоэлектронного и электрооптического анализа, разрабатываемых и применяемых в совместных исследованиях сотрудниками ИБФРМ РАН и СФ ИРЭ РАН. Заметим, что за разработку метода фагового дисплея пептидов и антител Д. Смиту и Г. Уинтеру была присуждена Нобелевская премия по химии 2018 года.
Перспективный современный подход на основе принципов «зеленой химии» применен для синтеза наночастиц золота и селена с использованием силимарина – флавоноида, получаемого из плодов и семян расторопши пятнистой. Полученные наноконъюгаты силимарина использованы для изучения их цитотоксичности по отношению к опухолевым и неопухолевым животным клеткам, показавшего ярко выраженный цитотоксический эффект в отношении линии опухолевых клеток Hep-2.
Научные интересы сотрудников группы ФРК связаны с изучением пространственно-временной организации и динамических изменений белков цитоскелета растений в зависимости от разнообразных внешних факторов. Динамичная структура актиновой составляющей цитоскелета является структурно-интегрирующей основой жизнедеятельности растительной клетки, обеспечивающей большой комплекс физиологических процессов: движение цитоплазмы, верхушечный рост пыльцевой трубки, корневых волосков, полярную ориентацию внутриклеточных органелл, участие в сигнальной системе и т.д.
Проводимые в этой области исследования включают: развитие методов визуализации микрофиламентов актина и тубулина, выделения и идентификации актинов из различных тканей растений; оценку роли актина в формировании микрорельефа поверхности протопластов клеток растений; анализ состояния цитоскелета клеток растений в зависимости от факторов внешней среды.
Кроме того, ведутся исследования механизмов образования, рецепции и физиологической роли олигосахаридных фрагментов в растительных тканях. Данные биомолекулы обладают плейотропным действием на клетки организмов различного уровня организации, участвуя в регуляции важнейших процессов жизнедеятельности. Это позволяет рассматривать олигосахариды как универсальные экстраклеточные сигнальные регуляторы межклеточных и межорганизменных взаимодействий.
Работы в данном направлении предусматривают изучение ферментативной фрагментации пектиновых полимеров растений, определяющих образование олигосахаридов различной степени полимеризации. Оценивается влияние структурно-функциональных модификаций пектиновых полисахаридов на их биологическую активность, действие пектиновых олигосахаридов на биосинтез и состав поверхностных и экстраклеточных протеомов клеток растений и микроорганизмов. Разрабатываются эффективные метки и зонды для выявления и исследования рецепторов олигосахаридов в растительных клетках.
Долгое время считалось, что цитоскелет характерен лишь для эукариот. Однако с начала 1990-х годов стали публиковаться данные, свидетельствующие о наличии цитоскелета и у прокариот. В частности, методом дот-анализа с использованием конъюгата фаллоидина с коллоидным золотом в клетках штамма A. brasilense Sp245 нами был обнаружен актиноподобный белок.
Это дало основания для анализа 3D структуры данного белка (MreB) и его сравнений со структурой растительного G-актина из Arabidopsis thaliana, проведенного нами впервые методом гомологичного моделирования по аминокислотной последовательности белка из генома A. brasilense Sp245, представленного в базе данных NCBI.
Можно отметить общее сходство 3D структур данных белков, при том что их аминокислотные последовательности идентичны только на 17,1%, а доля аминокислотных остатков со сходными физико-химическими и биохимическими характеристиками составляет 45,8%. Следует, однако, принимать во внимание, что механизмы и результаты функционирования актиноподобных белков MreB в клетках прокариот и их эволюционная история существенным образом отличаются от таковых для актинов эукариотических клеток (Doolittle R.F., York A.L. Bacterial actins? An evolutionary perspective. BioEssays. 2002. Vol. 24. P. 293-296; doi: 10.1002/bies.10079). К примеру, филаменты, образуемые белком MreB, служат для поддержания формы и контролируют размер палочкообразных клеток прокариот, но в геномах клеток сферической формы данный белок не обнаружен.
Разработан метод выделения и очистки гладкомышечного актина из животных тканей и получения на его основе антиактиновых антител. Получены конъюгаты золей коллоидного золота различного размера с очищенной фракцией IgG к актину. Разработан метод получения маркера на основе низкомолекулярного ингибитора полимеризации актина фаллоидина и коллоидного золота. Показана возможность дифференциальной оценки количества филаментной и глобулярной форм актинов с использованием этих маркеров с чувствительностью 15-50 нг белка.
Из предварительно обогащенных фракций цитозольных белков корней проростков пшеницы и эндокарпа плодов томата (защищенных от протеолиза) были выделены актиноподобные растительные белки разной степени очистки. Иммунохимический анализ показал различную эффективность выявления полипептидов в этих препаратах, что объясняется, по-видимому, более широкой вариабельностью структур актинов у растений по сравнению с животными.
Идентификация актина методами электронной и флуоресцентной микроскопии с применением специфического маркера фаллоидин-коллоидное золото и флуоресцентного зонда фаллоидин-TRITC показала наличие в препаратах из различных тканей и органов растений как отдельных микрофиламентов, так и разветвленной сети пучков филаментов. Оценка распределения актина в субклеточных структурах препаратов тотальных, свободных и мембранносвязанных полисом из листьев конских бобов впервые показала связь полисом с филаментной формой актинового цитоскелета.
Методом сканирующей электронной микроскопии с модификацией, исключающей применение аппарата «критическая точка», получены данные об особенностях структуры поверхности и субкортикального слоя протопластов, позволяющие судить о топографии субкортикального цитоскелета, его связи с процессами синтеза клеточной стенки.
Показано, что в процессе ферментативного гидролиза пектиновых полимеров деградация молекулы деэтерифицированного пектина протекает дискретно и детерминированно, что проявляется в образовании стабильного спектра олигосахаридов. Химическая модификация пектинового полисахарида остатками глюкозамина сохраняет дискретность фрагментации молекулы полимера, но изменяет спектр образующихся олигосахаридных фрагментов. Установлена возможность направленного изменения активности и тканевой специфичности пектиновых олигосахаридов на основе модификации их структуры биоактивными лигандами.
Разработан оригинальный метод получения препаратов белков поверхности и клеточной стенки растительных клеток. Выявлена способность пектиновых поли- и олигосахаридов стимулировать процессы морфогенеза и изменять спектр белков поверхности у клеток суспензионной культуры A. thaliana, а также некоторых штаммов бактерий рода Azospirillum.
В течение всего срока существования группой ФРК проводится также научно-сервисная работа для подразделений института, а также для других научно-учебных организаций, с применением просвечивающей и сканирующей электронной, флуоресцентной и конфокальной микроскопии, проведением разделения и анализа белков и других метаболитов с помощью высокоэффективной жидкостной хроматографии, седиментационного фракционирования и анализа биополимеров.
Подводя итог приведенному выше краткому перечислению полученных нами данных можно констатировать, что значение результатов работ, посвященных развитию методологии иммунохимических, биохимических и микробиологических исследований, не ограничено только целями изучения растительно-микробных ассоциаций. Эти результаты могут быть применены (и фактически используются различными исследовательскими коллективами у нас в стране и за рубежом) в более широком круге биологических и биомедицинских исследований.
Работы сотрудников лаборатории поддержаны грантами Президента РФ для ведущих научных школ, РФФИ, РНФ, Миннауки РФ, Президиумом РАН в рамках программ «Фундаментальные науки – медицине» и «Фундаментальные основы технологий наноструктур и наноматериалов», международным грантом Седьмой рамочной программы Евросоюза и др.
Сотрудники ЛИ выступают в качестве рецензентов работ, представляемых к публикации в российских и зарубежных научных изданиях. Вед. науч. сотр. д.б.н. Л.А. Дыкман включен в список победителей престижных международных премий «Scopus Award Russia» за вклад в развитие науки на национальном и международном уровне 2015 г. и «Самые влиятельные исследователи по версии Thomson Reuters» 2015 г., является членом American Nano Society, выполнял работу эксперта по категории «Научно-техническая экспертиза и экспертиза образовательных проектов» корпорации «Роснано», был назначен экспертом по приоритетному направлению «Индустрия наносистем» Федерального реестра экспертов научно-технической сферы, наряду с сотрудниками лаборатории нанобиотехнологии ИБФРМ РАН отмечен в 2004 г. премией МАИК «Наука» за лучшую публикацию в издаваемых ею журналах. Старш. науч. сотр. д.б.н. С.А. Староверов являлся экспертом по приоритетному направлению «Биотехнология» Федерального реестра экспертов научно-технической сферы (2012-2015 гг.). Зав. лаб. С.Ю. Щеголев также зарегистрирован в Федеральном реестре экспертов научно-технической сферы (2013-2016 гг., 2017-2019 гг.).
За многолетний добросовестный труд на благо отечественной науки, практический вклад в обеспечение фундаментальных и прикладных научных исследований вед. науч. сотр. д.б.н. Л.Ю. Матора, вед. науч. сотр. д.б.н. Л.А. Дыкман и старш. науч. сотр. к.б.н. Н.В. Евсеева в 2010 г. награждены Почетной грамотой Президиума РАН и Центрального совета Профсоюза работников РАН. Науч. сотр. к.б.н. А.А. Широков в 2013 г. стал лауреатом молодежной премии им. П.А. Столыпина правительства Саратовской области за выдающиеся достижения в области науки. Зав. лаб. С.Ю. Щеголев в 2006 г. награжден медалью ордена «За заслуги перед Отечеством» II степени.